裸质粒载体在基因治疗药物中的应用
- 分类:2018年
- 作者:
- 来源:
- 发布时间:2018-06-08
- 访问量:
【概要描述】一、基因治疗药物研发概况基因治疗是二十世纪九十年代发展起来的一种全新的疾病治疗模式,是通过载体将外源基因导入靶细胞,以纠正或改善致病基因所产生的缺陷,达到治疗疾病的目的。“GeneTherapyClinicalTrialsWorldwide”的统计,至2017年11月,全球范围共开展了2597个临床试验,主要集中于癌症、单基因遗传病以及心血管疾病等方面的治疗。2012年,欧洲首个基因治疗药物Gly
裸质粒载体在基因治疗药物中的应用
【概要描述】一、基因治疗药物研发概况基因治疗是二十世纪九十年代发展起来的一种全新的疾病治疗模式,是通过载体将外源基因导入靶细胞,以纠正或改善致病基因所产生的缺陷,达到治疗疾病的目的。“GeneTherapyClinicalTrialsWorldwide”的统计,至2017年11月,全球范围共开展了2597个临床试验,主要集中于癌症、单基因遗传病以及心血管疾病等方面的治疗。2012年,欧洲首个基因治疗药物Gly
- 分类:2018年
- 作者:
- 来源:
- 发布时间:2018-06-08 11:31
- 访问量:
一、基因治疗药物研发概况
基因治疗是二十世纪九十年代发展起来的一种全新的疾病治疗模式,是通过载体将外源基因导入靶细胞,以纠正或改善致病基因所产生的缺陷,达到治疗疾病的目的。根据“Gene Therapy Clinical Trials Worldwide”的统计,至2017年11月,全球范围共开展了2597个临床试验,主要集中于癌症、单基因遗传病以及心血管疾病等方面的治疗。2012年,欧洲首个基因治疗药物Glybera获得批准,成为基因治疗领域的里程碑;2017年,FDA批准3款基因治疗药物上市,截止目前全球已批准8个基因治疗药物,其中我国共批准2个;2018年1月Science杂志发表题为“Gene therapy comes of age”的文章,认为基因治疗迎来了新时代,再次引发医药界对基因治疗药物的广泛关注,大型跨国制药企业也开始向基因治疗研发方面进行实质性投资,基因治疗药物的研发进入快速发展阶段。
二、裸质粒基因治疗药物的研发现状
裸质粒基因治疗药物是以裸质粒作为目的基因载体开发的药物,是较为常见的一种基因治疗形式。目前全球范围内以裸质粒DNA为载体的基因治疗临床试验共开展了442个,排名第三;与以腺病毒和逆转录病毒为载体的临床试验数量基本相当。同病毒载体相比,裸质粒载体具有免疫原性和毒性更低的优势,不存在基因整合的风险,而且在生产、运输和储存过程中更方便,更有利于大规模生产。经统计,上述临床试验有200多个(占比55%)处于临床Ⅰ期阶段,而进入临床Ⅲ期的只有9个(表1),其中5个临床Ⅲ期临床试验的目的基因为肝细胞生长因子,表明裸质粒基因治疗药物大部分处于临床研究的早期阶段,且以肝细胞生长因子的裸质粒基因治疗药物研究例数最多,临床进展较快。
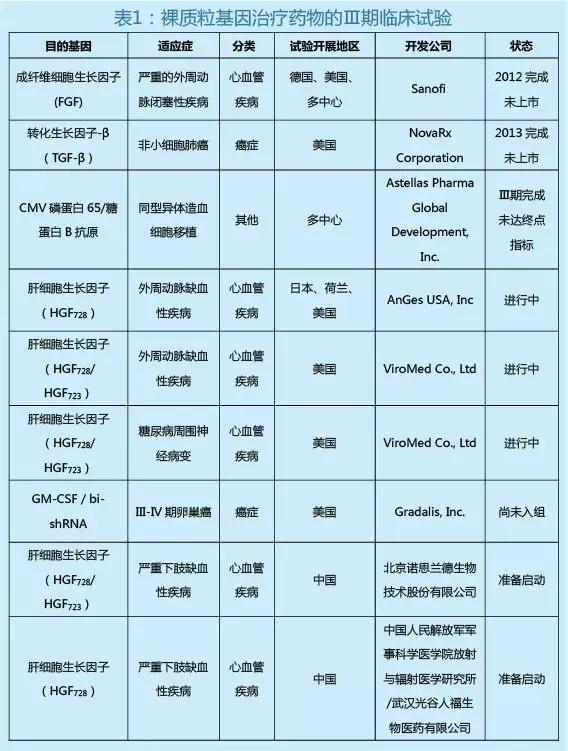
三、重组人肝细胞生长因子裸质粒基因治疗药物的研究进展
肝细胞生长因子(HGF)具有促血管生成作用,临床上可用于缺血性疾病的治疗。目前已进入临床试验阶段的HGF裸质粒基因治疗药物有3个,分别是日本AnGes-MG公司开发的pVAX1-HGF、中国人民解放军军事医学科学院开发的pUDK-HGF、北京诺思兰德生物技术股份有限公司与韩国ViroMed公司合作开发的pCK-HGF-X7。其中,pVAX1-HGF和pUDK-HGF的目的基因均为HGF的cDNA片段,只表达HGF728一种异构体,而pCK-HGF-X7能同时表达HGF728和HGF723两种异构体,更符合正常人体中HGF的分布和作用机理,临床前比较研究结果证实同时表达2种异构体的HGF裸质粒具有更强的生物学活性。
北京诺思兰德生物技术股份有限公司开发的基因治疗药物——pCK-HGF-X7,目前正在中国和美国同时开展Ⅱ/Ⅲ期临床试验。在美国开展的临床试验适应症为外周动脉缺血性疾病(Peripheral Artery Disease,PAD)、糖尿病周围神经病变(Diabetic Peripheral Neuropathy,DPN)和肌萎缩侧索硬化症(Amyotrophic Lateral Sclerosis,ALS)。其中pCK-HGF-X7治疗DPN适应症于2018年5月获得FDA再生医学先进疗法认定(Regenerative Medicine Advanced Therapy,RMAT)。RMAT认定是2016年12月美国FDA基于21 世纪治愈法案的新药加速策略,旨在加速用于严重疾病再生医学制品的开发及审批进程。通过RMAT认定,能加速FDA审评时间,有望实现本品的早日上市。在中国开展的临床试验的适应症为严重下肢缺血性疾病(Critical limb ischemia,CLI),是PAD病程的后期阶段,已于2017年10月获得III期临床批件,预计2020年申请上市,目前诺思兰德公司正计划在中国开展其他适应症的开发。
相关链接:https://mp.weixin.qq.com/s/YqLaRwdEnD9y693fgjx0HA
分享到:
扫二维码用手机看
在线留言
请留下您的宝贵意见或建议及联系方式(邮箱或电话),方便我们能及时回复您!
北京诺思兰德生物技术股份有限公司
一家专业从事基因治疗药物、重组蛋白质类药物和眼科用药物研发、生产及销售的创新型生物制药企业。

手机版网站

下肢缺血科学研究

心梗科学研究
版权所有 北京诺思兰德生物技术股份有限公司 京ICP备13017729号 网站建设:中企动力 保定
